Biología Fundamental del Virus de la Peste Porcina Africana
Nuestro grupo estudia la replicación del virus de la peste porcina africana (VPPA), uno de los patógenos más relevantes en el campo de la sanidad animal.
La peste porcina africana es una enfermedad hemorrágica que afecta a los cerdos domésticos y jabalíes euroasiáticos con tasas de mortalidad muy elevadas. Su reaparición en 2007 fuera del continente africano ha tenido un gran impacto socioeconómico y sanitario, con más de 80 países afectados en los cinco continentes. Actualmente, no existe una vacuna comercial ni ninguna otra estrategia antiviral efectiva.
El VPPA, único miembro hasta la fecha de la familia Asfarviridae, es un virus DNA de gran complejidad genética y estructural. Su genoma codifica más de 150 proteínas, 70 de las cuales forman parte de una partícula viral. El virión, de gran tamaño (250 nm) y morfología icosaédrica, posee una arquitectura singular organizada en múltiples capas concéntricas.
Nuestra investigación pretende dilucidar los mecanismos moleculares, celulares y estructurales subyacentes a las diferentes etapas del ciclo infectivo, en especial, la ruta de internalización en la célula huésped y el ensamblaje y liberación del virión infectivo. Para ello empleamos una combinación de metodologías bioquímicas, genéticas y biomoleculares, así como técnicas de microscopía óptica y electrónica y aproximaciones «ómicas».
El conocimiento de los mecanismos de infección, así como la identificación de los actores virales y celulares participantes, es fundamental para el desarrollo de estrategias profilácticas efectivas contra el VPPA.
Algunas contribuciones recientes de nuestro grupo:
- Atlas proteómico del virión: empleando técnicas de análisis proteómico e inmunomicroscopía electrónica, identificamos 70 proteínas diferentes en la partícula viral infectiva y determinamos la localización de 45 de ellas entre las diferentes capas estructurales del virión (Alejo et al, 2018. J. Virol).
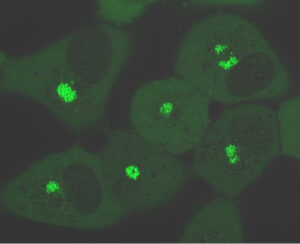
- Estructura del virión: mediante criomicroscopía electrónica determinamos la estructura del virión en colaboración con el grupo de Nicola Abrescia (CiC-Biogune). La partícula viral está formada por un nucleoide central, que contiene el genoma viral, rodeado sucesivamente por una cápsida icosaédrica interna (o core shell), una envuelta lipoproteica interna, una cápsida icosaédrica externa y una membrana lipídica externa (Andrés et al, 2020. J Biol Chem).

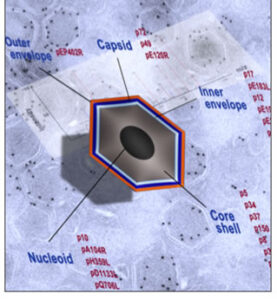
- Ruta de internalización del VPPA en la célula huésped: tras su endocítosis por macropinocitosis y endocitosis mediada por clatrina, la partícula viral penetra en la red endosomal, donde experimenta un desensamblaje parcial, inducido por pH ácido, que propicia la fusión de su envuelta interna con la membrana de endosomas tardíos (Hernáez et al, 2016. Plos Pathog; Andrés, 2017. J Virol). El proceso fusogénico depende críticamente de las proteínas transmembrana de la envuelta interna del virión: pE248R y pE199L (Matamoros et al, 2020. mBio).
- Mecanismo de ensamblaje del core viral: empleando un virus recombinante inducible y técnicas de microscopía óptica y electrónica, identificamos a la proteína transmembrana pE84R como un componente fundamental para el ensamblaje del core viral, que contiene el genoma. La proteína pE84R funciona como un conector entre la envuelta interna y el core a través de su interacción con la poliproteína del ´core shell` pp220. En ausencia de pE84R, se generan partículas icosaédricas vacías (Alejo et al, 2023. Plos Pathog).
- ASFV-Anchor: nuestro laboratorio ha generado en colaboración con la empresa NeoVirTech S.L (Toulouse, Francia) un virus recombinante que permite visualizar genomas virales en ´célula viva`. Entre otras aplicaciones, esta nueva herramienta permitirá estudiar la replicación del genoma viral así como la eficacia de compuestos antivirales (Martín et al, 2024. Antiviral Research).